
背景
「頭頸部」という言葉は一般には聞きなれない言葉だと思いますが、その範囲は頭の底から、鎖骨までの範囲で、この範囲に含まれる、耳、鼻、口(舌など)、上あご、下あご、のど(咽頭、喉頭)、唾液腺、甲状腺、頚部にできる腫瘍が「頭頸部腫瘍」で、そのうち悪性のものが「頭頸部がん」です。
頭頸部には呼吸・食事(咀嚼・嚥下)など、人間が生きる上で必要な機能、さらに発声、味覚、聴覚など社会生活を送る上で重要な機能(生活の質QOLに関わる)が集中しています。したがって、この部分のがんを治すためには根治性とQOLとのバランスを保った治療が必要です。また、顔面の形態の維持や表情の形成を行うのも頭頸部であり整容的な配慮も欠かせません。頭頸部がんは発生頻度こそ少ない(がん全体の5-7%程度)ですが、機能や形態を維持しながら治療するには様々な治療法を組み合わせた集学的な治療が必要となります。
当科では機能・臓器温存を重要視した臨床研究や、新規薬剤による副作用の少ない治療法の開発を進めています。
主な研究テーマ
1.低侵襲な手術方法の開発
近年、内視鏡の性能が格段に向上し、NBIと呼ばれる特殊な光の波長を利用した観察法などによって、従来の内視鏡では診断が困難であった早期がん、表在がんの診断が可能になってきました。これらの技術は当初は消化管領域で行われていましたが、その診断技法が咽喉頭領域にも応用されるようになり、早期がんとして見つかるケースが増えてきています。
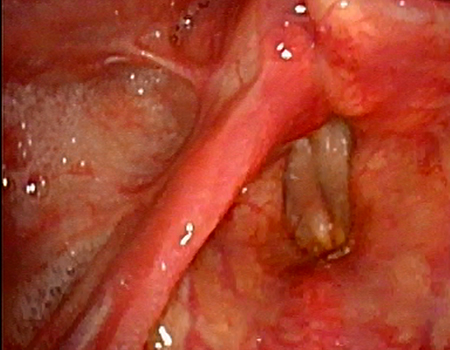
咽頭写真1(通常光) 咽頭写真2(NBIによる観察)
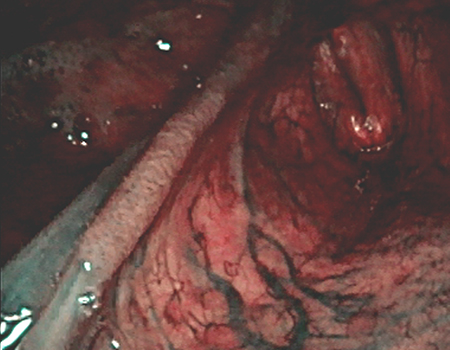
従来は咽頭がんの切除は頸部を切開して行うことが通常でしたが、症例によっては「口」から様々な器械を挿入し、内視鏡を用いてがんを切除することも可能となってきました。
海外では2009年米国FDAで承認されたことによりda Vinci🄬 surgical systemを使用した経口的ロボット支援手術(Trans Oral Robotic Surgery:TORS)が世界中で発展してきました。しかし日本では未承認であり、TORSは限られた施設でのみで先進医療として行われてきました。その代り、日本ではロボットを使わないTOVS(Trans Oral Video laryngoscopic Surgery)やELPS(Endoscopic Laryngo-Pharyngeal Surgery)といった日本独自の新しい手法が開発され、咽喉頭の早期がんに対する低侵襲手術として拡がりつつあります。当科では経口腔的な手術手技の改良、手術適応の拡大など目指して手術症例を重ね、耳鼻咽喉科単独で行うELPSの術式の確立、TOVSの手技を用いた経口腔アプローチによる副咽頭間隙腫瘍の切除など、咽喉頭の表在がん以外の領域への応用も進めてまいりました。
経口腔手術(TOVS)
2018年にようやく咽喉頭がんに対する薬事承認申請となり、日本頭頸部外科学会からロボット支援手術実施までのプロセスが示されました。・施設基準並びに医師の資格基準・トレーニング受講・症例準備・症例実施 といったプロセスを経て、ロボット支援手術の実施に向けて今後当科でも準備を進めてまいります。
2. PET (positron emission tomography)を用いた頭頸部がんの診断と治療効果の予測
機能温存・臓器温存を達成するためには病気の拡がり具合を正確に評価することから始まります。PET検査は2002年から保険適応となった検査法で、がんの診断には18F-FDG (fluorodeoxy glucose)を用います。FDGは砂糖(ブドウ糖)と同じ成分のため、注射されたFDGは体中の細胞に拡がります。取り込まれたFDGに引っ付いている核種(18F)が放出する陽電子をPET装置の検出器でとらえ、画像化することで、FDGが多く取り込まれた部分(がんなどの悪性腫瘍はFDGをたくさん取り込む性質があります)を評価することができます(図1)。
当科では18F-FDG以外にもDNA(遺伝子を構成する成分)の合成能を反映する18F-FLT, 11C-4DST や、低酸素状態を反映するといわれる18F-FMISOなどの新規薬剤を併用することで、診断の精度を高めたり(図2)、放射線治療の効果を判定(図3)、予測することで(図4)、最適な治療法の選択や、機能・臓器温存の可能性を追求しています。
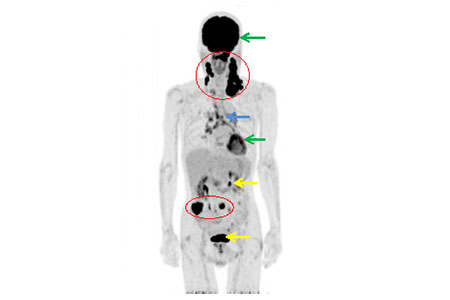
図1.中咽頭癌頚部リンパ節多発症例。赤丸で囲った部分が悪いところ。お腹にも
FDGの集積を認め、大腸がんが合併していた。それ以外、脳や心臓は生理的に
FDGが集積する場所(緑→)で、縦隔のリンパ節も喫煙による慢性炎症で集積
(青→)を認める。注射したFDGは最後に尿として排出されるため、腎臓や膀胱
にもFDGが集まっている(黄色→)。
FDG PET FLT PET
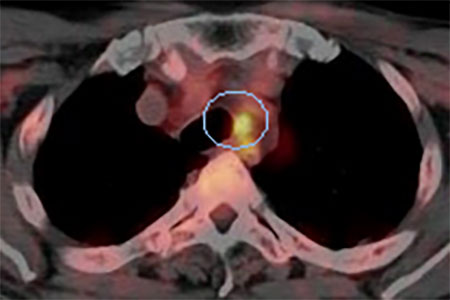
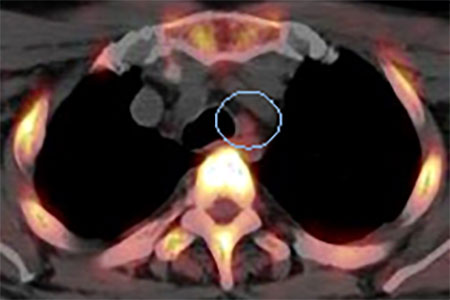
図2.中咽頭癌の縦隔リンパ節転移疑い症例
左はFDG PETによる画像で、リンパ節にFDGが集積し転移が疑われた。
右のFLT PET画像では集積を認めず、結果的には悪性所見はなかった。
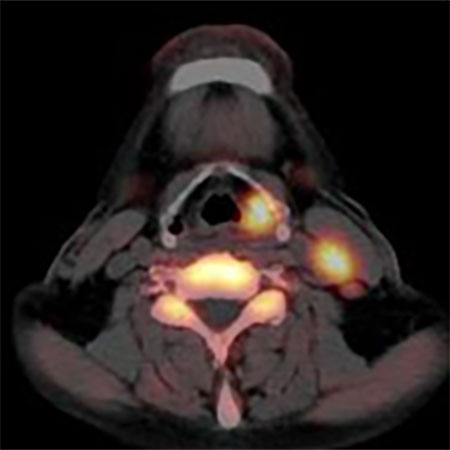
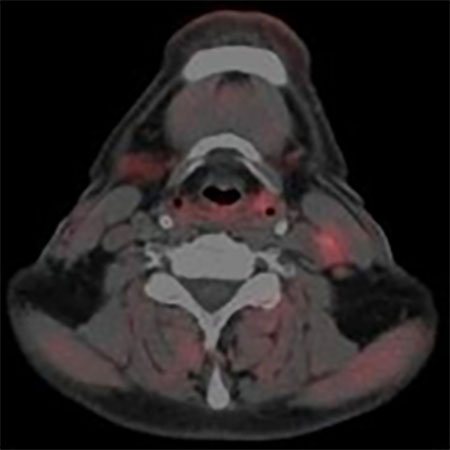
FDG PET 治療前 放射線治療中
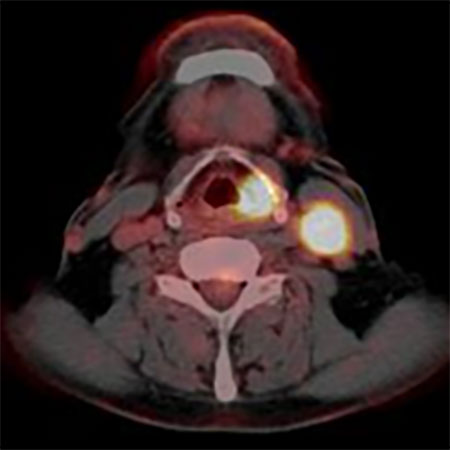
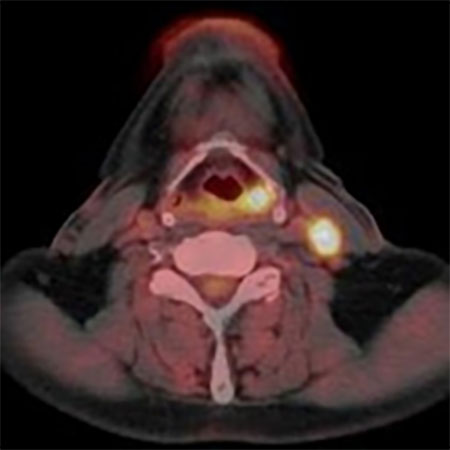
FLT PET 治療前 放射線治療中
図3.上段は下咽頭癌頚部リンパ節転移症例のFDG PET画像
下段は同じ症例のFLT PET画像
左は治療前、右は放射線治療30Gyの時点での画像。
FDG PETでは放射線治療途中でFDGの強い集積が
みられるが、FLT PETでは治療の途中でも集積が無く
なっており、治療の効果をより早く反映している。
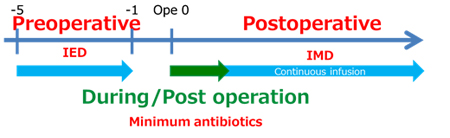
3. 周術期栄養療法
周術期栄養管理の目的は、合併症発生率や死亡率を減少させることにあります。まず栄養評価を行い(SGA(subjective global assessment、主観的包括的栄養評価))、栄養管理の必要性を判断します。通常、健康時体重の10%以上の体重減少があれば中等度以上の栄養障害ありと判断され、待機手術予定の患者も入院後に特別な栄養管理が必要と考えています。
免疫増強経腸栄養剤(IED)を周術期に投与すると、術後の感染性合併症発生率が約半分に減少するという多くの臨床データが報告されています。このような栄養管理はImmunonutritionと呼ばれ、特に待機手術患者の術前投与で効果が高いとされています。
我々は治療前(IED服用前)、術前(IED服用後)、術後の理学所見、血液検査を比較し、術前IEDがどの程度、栄養学的な影響を及ぼすかを検討しています。
4. 新規外皮用殺菌消毒剤ならびに抗菌薬適正使用でのSSI(手術部位感染)発生率の検討
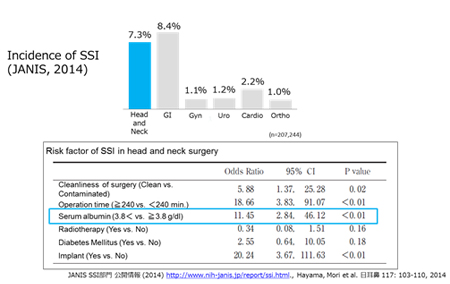
SSI発生率は手術の種類や手術を行う部位によって違います。例えば、上部消化管手術では8.4%、婦人科領域手術では1.1%、泌尿器系手術では1.2%、心血管系手術では2.2%という具合です*1。しかし、この発生率は医療技術や医療用品が大きく進歩することにより減少してきています。とはいえ、ゼロになったわけではありません。しかも頭頸部癌領域においては7.3%とほかの領域とくらべて決して低い結果ではありません。
*1JANIS(厚生労働省院内感染対策サーベイランス事業) 2014年のデータより
入院患者の院内感染の中で、SSIが占める割合は15%前後と言われており、尿路感染(腎臓から尿道までの尿路に起こる感染症のこと)に次いで2番目の多さです。さらに、手術患者の院内感染の中では38%と、最も多くを占めているのが実情です。
我々はWHO、日本外科感染症学会のガイドラインにのっとって治療を行っており、日本環境感染学会JHAIS委員会の手術部位感染サーベイランス部門にデータを集約しています。
こうした現状を踏まえ、我々は頭頸部領域において①手術部位に適切な術前処理(新規外皮用殺菌消毒薬)を行い、➁手術部位に適した抗菌薬を周術期に投与する、ことで*2、SSIゼロを目指す取り組みを行っています。
*2術後感染予防抗菌薬適正使用のための実践ガイドライン
http://www.chemotherapy.or.jp/guideline/jyutsugo_shiyou_jissen.pdf
頭頸部領域の基礎研究
副作用の少ないがん治療薬(希少糖D-アロース)の開発
希少糖は「自然界にその存在量が少ない単糖とその誘導体」で、自然界には微量にしか存在しないため、その機能や活性などは研究されていませんでした。近年、香川大学農学部の何森教授によって天然型単糖から希少糖を生産する方法が開発され、希少糖の有する特異な生理活性が次々と明らかになりつつあります。もっとも有名になったのがD-プシコースで、カロリーはほぼゼロなうえ、血糖上昇を抑える、脂肪の蓄積を押さえるなどの作用から、健康食品として広く用いられるようになっています。
D-アロースは天然に多数存在するグルコースの立体異性体で、様々ながん細胞の増殖を抑制するといった結果が得られています。当科では頭頸部がんの培養細胞を用いてD-アロースががん細胞の増殖を抑制することを確認しました(図1)。また、免疫不全マウスにがん細胞を移植し、がんが生着した後にD-アロースを局所に投与したところ、がんが縮小しまし、さらに従来の抗がん剤や放射線治療を併用することでがんは著明に縮小しました(図2)。今後はD-アロースの安全性をさらに確認するとともに、最適な投与量やタイミング、他の薬剤との組み合わせなどを詳細に検討し、臨床応用につなげていきたいと考えています。
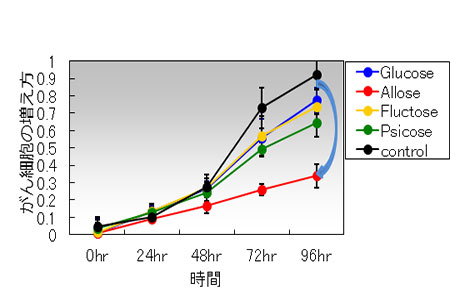
図1.培養した頭頸部がん細胞に様々な糖を加えて細胞の増殖を比較。
D-アロース(赤丸)を加えることで著明に細胞の増殖が抑制。
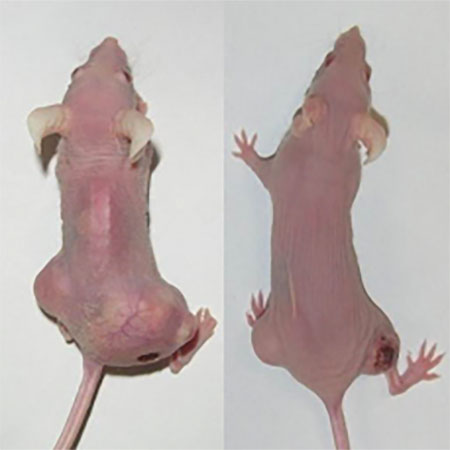

対象 D-アロース投与 放射線+抗がん剤 D-アロース+放射線+抗がん剤
図2.がん細胞を臀部に移植し、生着を確認後、5週間各治療を行った。
D-アロースの単独投与(週5回)と放射線+抗がん剤治療が同じくらいの
効果を示し、D-アロースを加えることで著明にがんが縮小した。